- Фазовая диаграмма воды
-
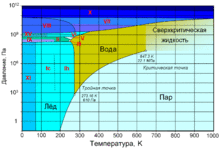 Фазовая диаграмма воды
Фазовая диаграмма воды
Фа́зовая диагра́мма воды — графическое отображение равновесного состояния фаз воды (жидкости, водяного пара и различных модификаций льда). Строится в системе координат температура—давление.
Содержание
Элементы фазовой диаграммы
Тройные точки
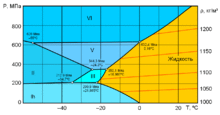
№ Фазы Давление Температура Примечание МПа °C K 1 Пар Вода Лёд Ih 611,657 Па 0,01 273,16 2 Пар Лёд Ih Лёд XI 0 −201,0 72,15 3 Вода Лёд Ih Лёд III 209,9 −21,985 251,165 4 Лёд Ih Лёд II Лёд III 212,9 −34,7 238,45 [5][6][7] 5 Лёд II Лёд III Лёд V 344,3 −24,3 248,85 [5][6] 6 Лёд II Лёд VI Лёд XV ~ 800 −143 130 Для D2O[8] 7 Вода Лёд III Лёд V 350,1 −16,986 256,164 [5][6] 8 Вода Лёд IV Лёд XII ~ 500—600 ~ −6 ~ 267 9 Лёд II Лёд V Лёд VI ~ 620 ~ −55 ~ 218 [10] 10 Вода Лёд V Лёд VI 632,4 0.16 273,32 [5][6] 11 Лёд VI Лёд VIII Лёд XV ~ 1500 −143 130 Для D2O[8] 12 Лёд VI Лёд VII Лёд VIII 2100 ~ 5 ~ 278 [11][12] 13 Вода Лёд VI Лёд VII 2216 81,85 355 [5][6] 14 Лёд VII Лёд VIII Лёд X 62 000 −173 100 [13] 15 Вода Лёд VII Лёд X 47 000 ~ 727 ~ 1000 [14][15] Кривая сублимации льда
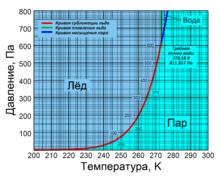
Кривая сублимации льда начинается в точке (0 Па; 0 K) и заканчивается в тройной точке воды (611,657 Па; 273,16 K). На этом участке при снижении температуры давление сублимации падает экспоненциально и при уже температуре 130 K составляет незначительную величину (10−8 Па).
С хорошей точностью давление сублимации на этом участке описывается экспонентой
где
Ошибка этой формулы — не более 1 % в диапазоне температур 240—273,16 K и не более 2,5 % диапазоне температур 140—240 K.
Более точно кривая сублимации описывается формулой, рекомендованной IAPWS (англ.)русск. (англ. International Association for the Properties of Water and Steam — Международная ассоциация по изучению свойств воды и пара)[16]:
где
Кривая плавления льда Ih
Кривая плавления льда Ih (то есть обычного льда) на фазовой диаграмме в области низких давлений представляет собой в практически вертикальную прямую. Так, при переходе от тройной точки (611 Па) к атмосферному давлению (101 кПа) температура плавления падает всего на 0,008 K (с 273,16 до 273,15 K). Давление, необходимое для снижения температуры плавления на 1 K составляет около 132 атм. Кривая плавления по горизонтальной оси занимает диапазон температур 251,165—273,16 K (–21,985 ... 0,01 °C). Минимальная температура плавления (–21,985 °С) достигается при давлении 208,566 МПа (2058 атм).
Кривая плавления льда Ih — единственный фазовый переход, связанный с изменением агрегатного состояния воды, который имеет обратный наклон (при увеличении давления температура плавления уменьшается). Это обстоятельство (в соответствии с принципом ле Шателье) объясняется тем, что лёд Ih имеет меньшую плотность по сравнению с водой при том же давлении. Все остальные модификации льда тяжелее воды, их температура плавления при повышении давления увеличивается.
Кривая плавления описывается формулой, рекомендованной IAPWS[16]:
где
Кривая плавления льда III
Кривая плавления льда III начинается в точке минимальной температуры затвердевания воды (251,165 K; 208,566 МПа), где обычный лёд превращается в структурную модификацию III, и заканчивается в точке (256,164 K; 350,1 МПа), где проходит граница фаз III и V.
Кривая плавления описывается формулой, рекомендованной IAPWS[16]:
где
Кривая плавления льда V
Кривая плавления льда V начинается в точке (256,164 K; 350,1 МПа), на границе фаз III и V, и заканчивается в точке (273,31 K; 632,4 МПа), где проходит граница фаз V и VI.
Кривая плавления описывается формулой, рекомендованной IAPWS[16]:
где
Кривая плавления льда VI
Кривая плавления льда VI начинается в точке (273,31 K; 632,4 МПа), на границе фаз V и VI, и заканчивается в точке (355 K; 2216 МПа), где проходит граница фаз VI и VII.
Кривая плавления описывается формулой, рекомендованной IAPWS[16]:
где
Кривая плавления льда VII
Кривая плавления льда VII начинается в точке (355 K; 2216 МПа), на границе фаз VI и VII, и заканчивается в точке (715 K; 20,6 ГПа), где проходит граница фазы VII.
Кривая плавления описывается формулой, рекомендованной IAPWS[16]:
где
Кривая насыщения водяного пара
Кривая насыщения водяного пара начинается в тройной точке воды (273,16 K; 611,657 Па) и заканчивается в критической точке (647,096 К; 22,064 МПа). Она показывает температуру кипения воды при указанном давлении или, что тоже самое, давление насыщенного водяного пара при указанной температуре. В критической точке плотность водяного пара достигает плотности воды и, таким образом, различие между этими агрегатными состояниями исчезает.
Согласно рекомендациям IAPWS, линия насыщения представляется в виде неявного квадратного уравнения относительно нормированной температуры θ и нормированного давления β[17]:
где
Для заданного абсолютного значения температуры T вычисляется нормированное значение θ и коэффициенты квадратного уравнения
после чего находится значение β
и абсолютное значение давления:
Давление насыщенного водяного пара (кПа) при различных температурах
T °C 0 1 2 3 4 5 6 7 8 9 0 0,6112 0,6571 0,7060 0,7581 0,8135 0,8726 0,9354 1,002 1,073 1,148 10 1,228 1,313 1,403 1,498 1,599 1,706 1,819 1,938 2,065 2,198 20 2,339 2,488 2,645 2,811 2,986 3,170 3,364 3,568 3,783 4,009 30 4,247 4,497 4,759 5,035 5,325 5,629 5,947 6,282 6,632 7,000 40 7,384 7,787 8,209 8,650 9,112 9,594 10,10 10,63 11,18 11,75 50 12,35 12,98 13,63 14,31 15,02 15,76 16,53 17,33 18,17 19,04 60 19,95 20,89 21,87 22,88 23,94 25,04 26,18 27,37 28,60 29,88 70 31,20 32,57 34,00 35,48 37,01 38,60 40,24 41,94 43,70 45,53 80 47,41 49,37 51,39 53,48 55,64 57,87 60,17 62,56 65,02 67,56 90 70,18 72,89 75,68 78,57 81,54 84,61 87,77 91,03 94,39 97,85 100 101,4 См. также
- Правило фаз
- Тройная точка воды
- Фазовая диаграмма
- Свойства воды
- Упругость водяного пара
- Лёд-девять (вымышленный материал)
Ссылки
- IAPWS. Сайт Международной ассоциации по изучению свойств воды.
- Water Phase Diagram.
- Теплофизические свойства воды и водяного пара.
- Phase-boundary curves of water.
- Saturation vapor pressure formulations.
- Water (Data Page).
Примечания
- ↑ L. A.Guildner, D. P. Johnson, and F. E. Jones Vapor pressure of water at its triple point (англ.) // J. Res. Nat. Bur. Stand.. — 1976. — Vol. 80A. — P. 505—521.
- ↑ M. J. Francis, N. Gulati and R. M. Pashley The dispersion of natural oils in de-gassed water (англ.) // J. Colloid Interface Sci.. — 2006. — Vol. 299. — P. 673—677.
- ↑ R. M. Pashley, M. Rzechowicz, L. R. Pashley and M. J. Francis De-gassed water Is a better cleaning agent (англ.) // J. Phys. Chem.. — 2005. — Vol. 109. — P. 1231—1238.
- ↑ R. M. Pashley, M. J. Francis and M. Rzechowicz The hydrophobicity of non-aqueous liquids and their dispersion in water under de-gassed conditions (англ.) // Curr. Opin. Colloid Interface Sci.. — 2008. — Vol. 13. — P. 236—244.
- ↑ 1 2 3 4 5 6 Release on the pressure along the melting and the sublimation curves of ordinary water substance. IAPWS, 1993.
- ↑ 1 2 3 4 5 6 P. W. Bridgman Water, in the liquid and five solid forms, under pressure. Proc. Am. Acad. Arts Sci. 47, 1912, 439—558.
- ↑ J. L. F. Abascal, E. Sanz, R. G. Fernández, and C. Vega A potential model for the study of ices and amorphous water: TIP4P/Ice. J. Chem. Phys. 122 (2005) 234511.
- ↑ 1 2 C. G. Salzmann, P. G. Radaelli, E. Mayer and J. L. Finney Ice XV: a new thermodynamically stable phase of ice. arXiv:0906.2489v1, cond-mat.mtrl-sci (2009).
- ↑ E. A. Zheligovskaya, G. G. Malenkov Crystalline water ices. Russian Chem. Rev. 75 (2006) 57-76.
- ↑ L. Mercury, P. Vieillard and Y. Tardy Thermodynamics of ice polymorphs and `ice-like' water in hydrates and hydroxides. Appl. Geochem. 16 (2001) 161—181.
- ↑ D. Eisenberg and W. Kauzmann The structure and properties of water. Oxford University Press, London, 1969.
- ↑ L. Pauling The structure of water. В кн.: Hydrogen bonding, Ed. D. Hadzi and H. W. Thompson, Pergamon Press Ltd, London, 1959, pp 1-6.
- ↑ M. Song, H. Yamawaki, H. Fujihisa, M. Sakashita and K. Aoki Infrared investigation on ice VIII and the phase diagram of dense ices. Phys. Rev. B 68 (2003) 014106.
- ↑ B. Schwager, L. Chudinovskikh, A. Gavriliuk and R. Boehler Melting curve of H2O to 90 GPa measured in a laser-heated diamond cell. J. Phys: Condens. Matter 16 (2004) S1177-S1179.]
- ↑ A. F. Goncharov, N. Goldman, L. E. Fried, J. C. Crowhurst, I-F. W. Kuo, C. J. Mundy and J. M. Zaug Dynamic ionization of water under extreme conditions. Phys. Rev. Lett. 94 (2005)125508.
- ↑ 1 2 3 4 5 6 Revised Release on the Pressure along the Melting and Sublimation Curves of Ordinary Water Substance. The International Association for the Properties of Water and Steam. Berlin, Germany, September 2008.
- ↑ Уравнения линии насыщения: Александров А.А, Орлов К. А., Очков В. Ф. Теплофизические свойства рабочих веществ теплоэнергетики: Интернет-справочник. — М.: Издательский дом МЭИ. 2009.
Литература
- J. L. Aragones, M. M. Conde, E. G. Noya, C. Vega The phase diagram of water at high pressures as obtained by computer simulations of the TIP4P/2005 model: the appearance of a plastic crystal phase (англ.) // Phys. Chem. Chem. Phys.. — 2009. — № 11. — P. 543–555.
- C. Vega, J. L. F. Abascal, M. M. Conde and J. L. Aragones What ice can teach us about water interactions: a critical comparison of the performance of different water models (англ.) // Faraday Discussions. — 2009. — Vol. 141. — P. 251—276.
- C. G. Salzmann, I. Kohl, T. Loerting, E. Mayer and A. Hallbrucker Pure ices IV and XII from high-density amorphous ice (англ.) // Can. J. Phys.. — 2003. — Vol. 81. — P. 25—32.
- Александров А.А, Орлов К.А., Очков В.Ф. Теплофизические свойства рабочих веществ теплоэнергетики: Интернет-справочник. М.: Издательский дом МЭИ (2009). Архивировано из первоисточника 26 мая 2012. Проверено 25 сентября 2010.
- Jana Kalovaa and Radim Maresb Equations for the Thermodynamic Properties at the Saturation Line in the Supercooled Water Region (англ.) // ICPWS XV : Preprint. — Berlin, September 8-11, 2008. — P. 1–5.
- W. Wagner, A. Saul, A. Pruβ International Equations for the Pressure along the Melting and along the Sublimation Curve of Ordinary Water Substance (англ.) // J. Phys. Chem. Ref. Data : Preprint. — 1994. — Vol. 23. — № 3. — P. 515—527.
- Percy W . Bridgman General survey of certain results in the field of high-pressure physics (англ.) : Nobel Lecture. — December 11, 1946.
- Д. В. Анцышкин, А. Н. Дунаева, О. Л. Кусков Термодинамика фазовых переходов в системе лед-VI — лед-VII — вода (англ.) // Геохимия. — 2010. — № 7. — С. 675-684.
- José Teixeira The «puzzle» of Water Behavior at Low Temperature (англ.) // Water. — 2010. — № 2. — С. 702-710.
- Wely Brasil Floriano, Marco Antonio Chaer Nascimento Dielectric Constant and Density of Water as a Function of Pressure at Constant Temperature (англ.) // Brazilian Journal of Physics. — March, 2004. — Т. 34. — № 1. — С. 38—41.
Для улучшения этой статьи желательно?: Категории:- Вода
- Физическая химия
- Материаловедение
- Термодинамика
- Диаграммы
Wikimedia Foundation. 2010.





![~\frac{P}{P_0} = 1 + \sum_{i=1}^3 a_i\left[1 - \left({T\over T_0} \right)^{b_i}\right],](c247f2c546c75398388796156aa9def3.png)

![~\frac{P}{P_0} = 1 - 0,299948 \left[ 1 - \left({T\over T_0}\right)^{60} \right],](2d236677fd4a93431074b4a39b21a5bc.png)

![~\frac{P}{P_0} = 1 - 1,18721 \left[ 1 - \left({T\over T_0}\right)^{8} \right],](e80449bf905d0a7aa243de1a35218fd6.png)

![~\frac{P}{P_0} = 1 - 1,07476 \left[ 1 - \left({T\over T_0}\right)^{4,6} \right],](357a36f2dc5e21570df7f583d4e60381.png)





















