- Нитрат висмута
-
Нитрат висмута Общие Систематическое наименование Нитрат висмута Традиционные названия Азотнокислый висмут Химическая формула Bi(NO3)3 Физические свойства Молярная масса 394,99 г/моль Плотность гидр. 2,83 г/см³ Термические свойства Температура плавления гидр. 75 °C Классификация Рег. номер CAS 10361-44-1
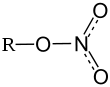
гидр. 10035-06-0Нитрат висмута — неорганическое соединение, соль металла висмута и азотной кислоты с формулой Bi(NO3)3, бесцветные кристаллы, гидролизуются водой, образует кристаллогидрат.
Содержание
Получение
- Растворение висмута, оксида висмута, гидроксида висмута или основного карбоната висмута в разбавленной азотной кислоте:
- Безводную соль можно получить реакций висмута и оксида азота:
- или обменной реакцией в ацетоне:
Физические свойства
Нитрат висмута образует бесцветные кристаллы, гидролизуются водой, устойчив в подкисленных растворах.
Образует кристаллогидрат состава Bi(NO3)3•5H2O, который плавится при 75°С в собственной кристаллизационной воде. Кристаллогидрат имеет строение [Bi(H2O)3(NO3)3]•2H2O.
Химические свойства
- Безводная соль разлагается при нагревании:
- Кристаллогидрат при хранении на воздухе медленно разлагается:
- При нагревании кристаллогидрат гидролизуется собственной водой:
- В разбавленных водных растворах при кипячении подвергается полному гидролизу:
- Реагирует с концентрированной холодной соляной кислотой:
- Реагирует с щелочами:
- Под действием окислителей образуются висмутаты:
- В кислой среде с фторидами вступает в обменные реакции:
- Вступает в другие обменные реакции:
Применение
- В фармакологии при болезнях желудочно-кишечного тракта, при кожных заболеваниях, как антисептический препарат.
- Вводится в состав отбеливающих кремов, кремов от веснушек, в краски для волос.
- Пигмент — жемчужные или испанские белила.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
НитратыДинитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2)
 Категории:
Категории:- Соединения висмута
- Нитраты
Wikimedia Foundation. 2010.













![\mathsf{Bi(NO_3)_3 + 4HCl \ \xrightarrow{0^oC}\ H[BiCl_4] + 3HNO_3 }](3b31bbca9ebc8404d8fe91f25dc408a1.png)





