- Фторид кобальта(II)
-
Фторид кобальта(II)
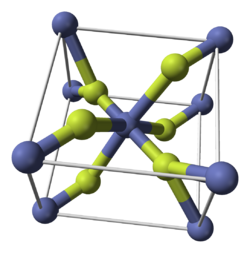
Систематическое название Фторид кобальта(II)
Другие названия Дифторид кобальта
Химическая формула CoF2
Внешний вид розовато-красные кристаллы
Свойства Молярная масса Температура плавления 1127 °C (1400.15 К)
Температура кипения 1740 °C (2013.15 К)
Плотность безводный: 4,46 г/см³
тетрагидрат: 2,19 г/см³Растворимость в воде 1,5 г/100 мл
Токсикологические данные LD50 150 мг/кг
Структура Кристаллическая решётка тетрагональная
Термодинамические свойства Стандартная энтальпия образования −665,7 кДж/моль
Стандартная молярная энтропия +82 Дж/(моль·К)
Стандартная энергия образования Гиббса −621 кДж/моль
Классификация Регистрационный номер CAS 10026-17-2 (безводный)
13817-37-3 (тетрагидрат)Регистрационный номер EC Безопасность R-фразы R25; R34
S-фразы S26; S36/37/39; S45
H-фразы H301; H314
P-фразы P280; P301 + P310; P305 + P351 + P338; P310
NFPA 704 Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). Фтори́д ко́бальта(II) (дифтори́д ко́бальта) — неорганическое вещество с химической формулой CoF2, соединение кобальта и фтора. Относится к классу бинарных соединений, соль кобальта и фтороводородной кислоты. Кристаллическое вещество красно-розового цвета.
Содержание
Физические свойства
Фторид кобальта(II) при нормальных условиях — твёрдое вещество розово-красного цвета, растворимое в воде (14,5 г/л при 25 °C), нерастворимое в этаноле. Плавится и кипит без разложения.[1][2] Имеет тетрагональную сингонию кристаллической решётки, пространственная группа P42/mnm, а = 0,46951 нм, с = 0,3179 нм, Z = 2.[3]
При кристаллизации из водного раствора образует кристаллогидраты состава CoF2·4H2O и CoF2·2H2O. При осаждении из фтороводородной кислоты образует кристаллогидрат состава CoF2·5HF·6H2O.[1][3]
Тетрагидрат фторида кобальта(II) разлагается, теряя кристаллизационную воду, при 300 °C.[2]
Химические свойства
Фторид кобальта(II) вступает в следующие химические реакции.[1]
- Реагирует с горячей концентрированной серной кислотой с образованием сульфата кобальта(II) и газообразного фтороводорода:
- Реагирует с концентрированной (40 %) щёлочью с образованием осадка тетрагидроксокобальтата(II):
- С концентрированным гидратом аммиака образует комплексную соль — фторид гексаамминокобальта(II):
- При длительном кипячении водного раствора разлагается с образованием осадка гидроксофторида кобальта(II) и фтороводорода:
- Реагирует с водяным паром с образованием оксида кобальта(II):
- Реагирует с расплавами фторида натрия и фторида калия с образованием ряда фторокомплексов:
- При нагревании в токе фтора окисляется до фторида кобальта(III):
- Окисляется концентрированным пероксидом водорода в присутствии карбоната натрия с образованием зелёного осадка трикарбонатокобальтата(III) натрия:
- При электролизе раствора фторида кобальта(II) в концентрированной фтороводородной кислоте на аноде образуется осадок 3,5-гидрата фторида кобальта(III):
 (анод)
(анод)  (катод)
(катод)
Получение
Фторид кобальта(II) может быть получен следующими способами.[1]
- Нагреванием хлорида кобальта(II) или оксида кобальта(II) в токе фтороводорода:
- Термическим разложением фторида кобальта(III):
Также фторид кобальта(II) может быть получен:[3]
- путём термического разложения трифторокобальтата(II) аммония (NH4CoF3);
- осаждением из водных растворов солей кобальта(II) фтороводородной кислотой.
Применение
Фторид кобальта(II) является промежуточным продуктом при получении фторида кобальта(III), комплексных фторидов кобальта(III) и кобальта(IV). Применяется в производстве катодов для химических источников тока, как компонент лазерных материалов, как катализатор в производстве фторуглеводородов.[3]
Токсичность
Фторид кобальта(II) является высокотоксичным веществом — LD50 для крыс перорально составляет 150 мг/кг. При контакте вызывает ожоги кожи и глаз, при проглатывании вызывает ожоги ЖКТ. При вдыхании оказывает крайне разрушительное воздействие на слизистые оболочки и верхние дыхательные пути.
См. также
Примечания
- ↑ 1 2 3 4 Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 112—113. — 637 с. — ISBN 978-5-358-01303-2
- ↑ 1 2 Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 96, 459, 620. — 685 с. — ISBN 5-7107-8085-5
- ↑ 1 2 3 4 Галогениды кобальта на xumuk.ru. Архивировано из первоисточника 29 августа 2012.
Соединения фтораГексафторалюминат натрия (Na3AlF6) • Гексафтороантимонат водорода (HSbF6) • Гексафторид платины (PtF6) • Гексафторид селена (SeF6) • Гексафторид теллура (TeF6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторогерманат рубидия (Rb2[GeF6]) • Гексафторогерманат цезия (Cs2[GeF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторосиликат натрия (Na2SiF6) • Гексафторплатинат ксенона (XePtF6) • Гексафторсиликат аммония ((NH4)2SiF6) • Гептафторид рения (ReF7) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрофторид аммония ([NH4][HF2]) • Гидрофторид калия (HF2K) • Декафторид дисеры (S2F10) • Диоксидифторид (F2O2) • Диоксидифторид молибдена(VI) (MoF2O2) • Дифтордиазин (N2F2) • Дифторид радона (F2Rn) • Кремнефтористоводородная кислота (H2SiF6) • Монофторид алюминия (AlF) • Монофторид углерода (CF) • Оксид-фторид урана (UO2F2) • Окситетрафторид вольфрама(VI) (WOF4) • Окситетрафторид молибдена(VI) (MoOF4) • Оксифторид иттрия (YOF) • Оксифторид лантана(III) (LaOF) • Оксотетрафторид ксенона (XeOF4) • Оксотрифторид ванадия(V) (F3OV) • Пентафторид висмута (BiF5) • Пентафторид мышьяка (AsF5) • Пентафторид сурьмы (SbF5) • Пентафторид урана (UF5) • Пентафторид фосфора (PF5) • Субфторид серебра (Ag2F) • Тетрафторалюминат калия (KAlF4) • Тетрафтороборат лития (LiBF4) • Тетрафтороборат меди(II) (Cu(BF4)2) • Тетрафтороборат натрия (NaBF4) • Тетрафтороборат нитрозила (BF4NO) • Тетрафтороборат нитрония (BNO2F4) • Тетрафтороборат серебра (AgBF4) • Тетрафторборная кислота (HBF4) • Тетрафторид дибора (B2F4) • Тетрафторид кремния (SiF4) • Тетрафторид селена (SeF4) • Тетрафторид теллура (TeF4) • Тетрафторгидразин (N2F4) • Трифторид алюминия (AlF3) • Трифторид бора (BF3) • Трифторид мышьяка (AsF3) • Трифторид висмута (BiF3) • Трифторид сурьмы (SbF3) • Трифторид тиазила (NSF3) • Трифторид фосфора (PF3) • Фторфосфат натрия (Na2PFO3) • Фторамин (NH2F) • Фторид азота(III) (NF3) • Фторид аммония (NH4F) • Фторид бария (BaF2) • Фторид бериллия (BeF2) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Фторид ванадия(III) (VF3) • Фторид ванадия(IV) (VF4) • Фторид ванадия(V) (VF5) • Фторид вольфрама(VI) (WF6) • Фторид галлия(III) (GaF3) • Фторид гафния(IV) (HfF4) • Фторид дейтерия (DF) • Фторид диртути(2+) (Hg2F2) • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Фторид золота(III) (AuF3) • Фторид золота(V) (AuF5) • Фторид индия(III) (InF3) • Фторид иода(I) (IF) • Фторид иода(III) (IF3) • Фторид иода(V) (IF5) • Фторид иода(VII) (IF7) • Фторид иридия(IV) (IrF4) • Фторид иридия(V) (IrF5) • Фторид иридия(VI) (IrF6) • Фторид иттербия(III) (YbF3) • Фторид иттрия (YF3) • Фторид иттрия-лития (LiYF4) • Фторид кадмия (CdF2) • Фторид калия (KF) • Фторид кальция (CaF2) • Фторид кислорода(II) (OF2) • Фторид кобальта(II) (CoF2) • Фторид кобальта(III) (CoF3) • Фторид криптона(II) (KrF2) • Фторид ксенона(II) (XeF2) • Фторид ксенона(IV) (XeF4) • Фторид ксенона(VI) (XeF6) • Фторид лития (LiF) • Фторид магния (MgF2) • Фторид марганца(II) (MnF2) • Фторид марганца(III) (MnF3) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Фторид молибдена(VI) (MoF6) • Фторид натрия (NaF) • Фторид никеля(II) (NiF2) • Фторид ниобия(V) (NbF5) • Фторид нитрозила) (NOF) • Фторид оксида азота(IV) (NO2F) • Фторид оксида серы(IV) (SO2F2) • Фторид олова(II) (SnF2) • Фторид олова(IV) (SnF4) • Фторид плутония(III) (PuF3) • Фторид плутония(IV) (PuF4) • Фторид плутония(VI) (PuF6) • Фторид радия (RaF2) • Фторид рения(IV) (ReF4) • Фторид рения(VI) (ReF6) • Фторид рения(VII) (ReF7) • Фторид ртути(II) (HgF2) • Фторид рубидия (RbF) • Фторид самария(III) (SmF3) • Фторид свинца(II) (PbF2) • Фторид серебра(I) (AgF) • Фторид серебра(II) (AgF2) • Фторид серы(IV) (SF4) • Фторид серы(VI) (SF6) • Фторид скандия(III) (ScF3) • Фторид стронция (SrF2) • Фторид таллия(I) (TlF) • Фторид тантала(V) (TaF5) • Фторид теллура(IV) (TeF4) • Фторид технеция(VI) (TcF6) • Фторид тиазила (NSF) • Фторид тианила (SOF2) • Фторид титана(III) (TiF3) • Фторид титана(IV) (TiF4) • Фторид тория(IV) (ThF4) • Фторид урана(III) (UF3) • Фторид урана(IV) (UF4) • Фторид урана(V) (UF5) • Фторид урана(VI) (UF6) • Фторид хлора(I) (ClF) • Фторид хлора(III) (ClF3) • Фторид хлора(V) (ClF5) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фторид цезия (CsF) • Фторид цинка (ZnF2) • Фторид циркония(IV) (ZrF4) • Фторид-хлорид оксида серы(IV) (ClFO2S) • Фторноватистая кислота (HOF) • Фтороводород (HF) • Фторосульфоновая кислота (FSO3H) • Фторид хлорила (ClO2F) • Фторид перхлорила (ClO3F) • Фторид оксиперхлорила (ClO3OF)
Растворимость кислот, оснований и солей в водеH+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? Категории:- Фториды
- Соединения кобальта
Wikimedia Foundation. 2010.







![\mathsf{CoF_2\ +\ 4NaOH\ \longrightarrow\ Na_2[Co(OH)_4] \downarrow\ +\ 2NaF}](478cddbb58d2092b308b9444d640c894.png)
![\mathsf{CoF_2\ +\ 6(NH_3 \cdot H_2O)\ \longrightarrow\ [Co(NH_3)_6]F_2\ +\ 6H_2O}](34f8670106120fc936e48ed46fd1d470.png)


![\mathsf{CoF_2\ \xrightarrow{MF}\ M[CoF_3],\ M_2[CoF_4],\ M_4[CoF_6]\ (M\ =\ Na,\ K)}](88825e2aa7431f8c64aaf69f320599ab.png)

![\mathsf{2CoF_2\ +\ H_2O_2\ +\ 6Na_2CO_3\ \longrightarrow\ 2Na_3[Co(CO_3)_3] \downarrow\ +\ 2NaOH\ +\ 4NaF}](59ef3159b0e6fa3d8f6cb5f31e827eed.png)



